Die Wasserstoffbrückenbindungen des Wassers: Was macht sie für das Leben, wie wir es kennen, so wichtig? – Dr. Arturo Robertazzi

Wie können die Wasserstoffbrückenbindungen des Wassers einen so kolossalen Einfluss auf die Existenz von Leben auf der Erde und möglicherweise überall sonst haben?
Quelle: Water’s Hydrogen Bonds: What Makes Them Vital for Life As We Know It? | From Atoms To Words
Ich erinnere mich, wie ich im ersten Jahr meines Studiums in einem kühlen Chemiesaal saß und unser Professor leidenschaftlich die außergewöhnlichen Eigenschaften von Wasser beschrieb. Es war eine scheinbar alltägliche Substanz, die unsere Gläser füllte, weite Teile des Ozeans bedeckte und als Regen vom Himmel fiel. Ich erinnere mich, dass ich damals auf eine Geschichte stieß, in der Enrico Fermi behauptete, dass das eigentümliche Verhalten des Wassers – die Verringerung seiner Dichte beim Gefrieren – der ultimative Beweis für die Existenz Gottes sei. Diese einzigartige Eigenschaft des Wassers, die es dem Leben ermöglicht, in den Ozeanen zu gedeihen und somit das Leben auf der Erde zu ermöglichen, schien fast zu perfekt, zu gewollt. Das Fermi-Zitat? Nun, das gibt es nicht. Und doch ist es wahr, dass die bemerkenswerten, manchmal sogar anomalen Eigenschaften des Wassers eng mit dem Leben, wie wir es kennen, verbunden sind. Die Quelle dieses Zaubers? Alles läuft auf die Wasserstoffbrückenbindungen des Wassers und ihre spezifische Stärke hinaus. Wie kommt es also, dass dieses mikroskopisch kleine Detail eine so kolossale Wirkung hat? Lesen Sie weiter, denn das ist der Kern der heutigen Geschichte. Also, schnappen Sie sich Ihr Lieblingsgetränk (Wasser vielleicht?) und los geht’s.
Die Essenz des Wassers: Mehr als nur H20
Haben Sie schon einmal über das Wasser nachgedacht, das Sie trinken, über den Regen, der fällt, oder über das Eis, das Ihren Aperol Spritz kühlt? Es ist nicht nur H20.
Es gibt eine kosmische Suche, die weit über unseren blauen Himmel hinausgeht. Wissenschaftler haben in unserem Sonnensystem einen Wasserreichtum entdeckt, der die Vorräte der Erde in den Schatten stellt. Die Rede ist von satten 32,5 bis 65 Milliarden Kubikkilometern des Stoffes. Das ist bis zu 50 Mal mehr als das Wasser, das in unseren Ozeanen, Flüssen und Teetassen herumwirbelt.
Aber was hat es mit dem vielen Wasser da draußen auf sich? Es eröffnet die Möglichkeit, dass das Leben seine Magie in Gegenden weit jenseits der unsrigen versprüht. Eis und Wasserdampf sind im Universum weit verbreitet. Der Star unter den Künstlern, flüssiges Wasser, ist jedoch etwas schwer fassbar.
Und das bringt mich zu der großen Frage von heute: Warum ist Wasser so wichtig für das Leben?
Wasser dient als Medium für die Umwandlung hochkomplexer organischer Moleküle, die die Grundlage für Lebensprozesse bilden. Der Grund für viele der besonderen Eigenschaften von flüssigem Wasser liegt darin, dass die Wassermoleküle aus Dipolen bestehen, die sich in der kondensierten Phase durch intermolekulare Wasserstoffbrückenbindungen verbinden.
F. H. Frimmel | 2007
Wassermoleküle mögen wie Zweitbesetzungen im großen Theaterstück des Universums erscheinen, aber in Wirklichkeit sind sie die Hauptdarsteller der Show. Wassermoleküle vollführen Kunststücke, die andere Flüssigkeiten vor Neid erblassen lassen.
Wenn man darüber nachdenkt, ist Wasser so etwas wie ein Rebell in der Welt der Chemie. Es folgt nicht der Masse. Würde sich Wasser wie andere Flüssigkeiten verhalten, die 71% unseres Planeten bedecken, hätten wir vielleicht nicht das Leben, das wir heute kennen.
Stellen wir Wasser also wieder ins verdiente Rampenlicht.
Wasser ist die einzige anorganische Verbindung, die in der Natur in drei Phasen – fest, flüssig und gasförmig – bei den auf der Erde üblichen Temperaturen vorkommt. Wasser wird oft als das universelle Lösungsmittel bezeichnet. Es ist das Medium, in dem die komplexen Wechselwirkungen der Biomoleküle die Geschichte der Lebensprozesse weben.
Und der Hauptakteur in diesem Ensemble? Die Wasserstoffbrückenbindung.
Um des Lebens willen: Die anomalen Eigenschaften des Wassers
Auf meiner Webseite haben wir bereits die Macht der Wasserstoffbrückenbindungen in den katalytischen und genetischen molekularen Maschinen, unseren Proteinen und der DNA, erforscht, aber bevor wir tiefer in die Chemie eintauchen, wollen wir zunächst einige der einzigartigen Eigenschaften von Wasser erkunden, die es für das Leben unverzichtbar machen:
- Breiter Temperaturbereich für den flüssigen Zustand: Wasser bleibt von 0°C bis 100°C auf Meereshöhe flüssig und bietet damit einen weitaus größeren Lebensbereich als andere Lösungsmittel wie Methan oder Ammoniak.
- Hohe Oberflächenspannung: Die starke Anziehungskraft zwischen den Wassermolekülen an der Oberfläche führt zu einer hohen Oberflächenspannung, einer lebenswichtigen Eigenschaft für viele Lebensformen und Überlebensmechanismen der Pflanzen.
- Anomale Dichte: Im Gegensatz zu den meisten anderen Stoffen nimmt die Dichte von Wasser ab, wenn es gefriert. Dadurch schwimmt Eis und bildet eine Isolierschicht, die das Leben unter Wasser in rauen Klimazonen schützt.
- Robuste Wasserstoffbindungen: Die starke Elektronegativität des Sauerstoffs in den Wassermolekülen führt zu robusten Wasserstoffbrückenbindungen, die einen breiteren Temperaturbereich für flüssiges Wasser ermöglichen, was für die Vielfalt des Lebens entscheidend ist.
Wissen Sie, diese einzigartigen Eigenschaften des Wassers sind nicht nur zufällige Macken, sie sind entscheidend für die ganze Geschichte des Lebens.
Denken wir einmal darüber nach: Wasser hat seine höchste Dichte bei 4°C. Das bedeutet, dass Wasser bei dieser Temperatur etwas ziemlich Ungewöhnliches tut – es dehnt sich aus, egal ob es sich abkühlt oder aufheizt. Dieses anomale Verhalten, das es nur bei Wasser gibt, hat eine Reihe von Auswirkungen in der Natur. Da Wasser bei 4°C am dichtesten und Eis am wenigsten dicht ist, frieren Seen und Flüsse von oben nach unten zu, wodurch das Leben unter Wasser geschützt wird und die Nährstoffe unten zirkulieren.
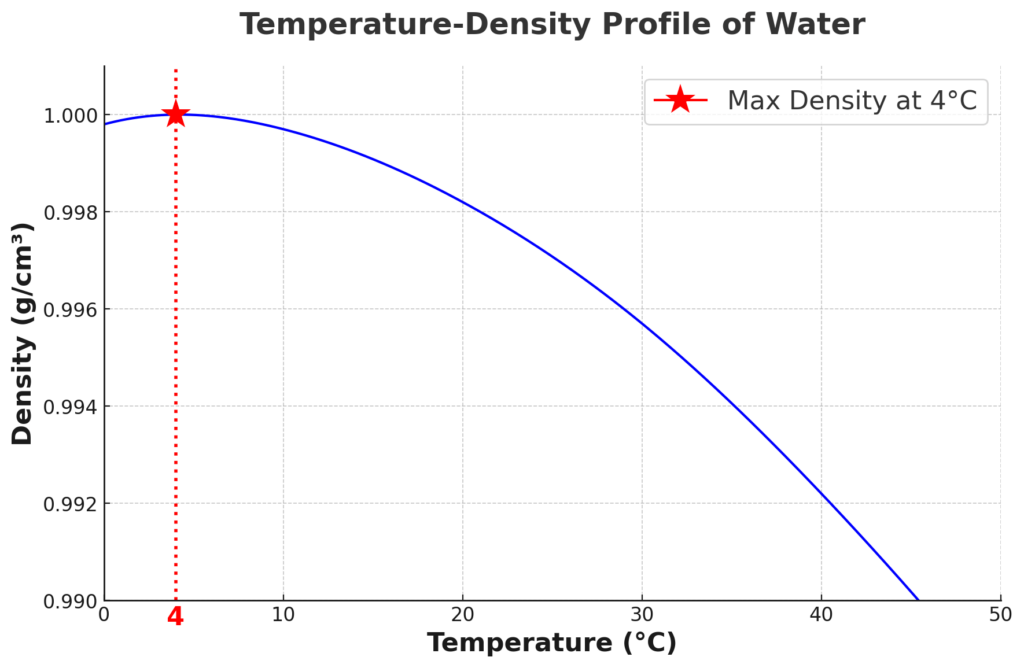
Stellen Sie sich vor, das Eis würde genau das Gegenteil tun und sinken. Dann hätten wir im Winter ein ganz anderes Szenario, oder? Anstatt oben eine frostige Decke zu bilden, würde das Eis auf den Grund sinken und Seen und Flüsse in gefrorene Gräber für alle Lebewesen dort unten verwandeln.
Und vergessen wir nicht die große Temperaturspanne, die Wasser im flüssigen Zustand hat. Dieser Bereich ist wie eine große, einladende Umarmung für das Leben, die sich von den heißen, feuchten Tropen bis zu den eisigen Polen erstreckt. Die Fähigkeit des Wassers, Wärme zu speichern und zu transportieren, prägt das Klima auf unserem Planeten und hat Einfluss darauf, wie und wo sich die verschiedenen Arten im Laufe der Zeit entwickelt haben. Und auf molekularer Ebene ist Wasser dank seiner Polarität, hohen Dielektrizitätskonstante und geringen Größe ein hervorragendes Lösungsmittel, insbesondere für polare und ionische Verbindungen.
Wasser spielt auch eine große Rolle, wenn es um die Hydratisierung von Biomolekülen wie Proteinen und Nukleinsäuren geht, und bestimmt so deren Funktion und Form.
Von der kleinsten atomaren Ebene bis hin zu den riesigen Ozeanen ist Wasser sozusagen das Lebenselixier unseres Planeten. Es ist so sehr mit der Essenz des Lebens verwoben, dass ohne es die Geschichte des Lebens hier, dort und vielleicht überall unerzählt bliebe.
Also ja, Wasser ist eine große Sache. Und wer ist der geheime Akteur hinter all diesen erstaunlichen Leistungen? Richtig, die Wasserstoffbrückenbindung.
Die Wasserstoffbrückenbindungen des Wassers: Maßgeschneidert für das Leben?
Bereits 1920 machten Latimer und Rodebush eine faszinierende Beobachtung : Ein Wasserstoffatom im Wasser wird nicht nur von einem Atom angezogen, sondern von zwei. Im Jahr 1948 fügte Linus Pauling ein weiteres Puzzleteil hinzu und betonte, dass diese Wasserstoffatome zur Bildung einer so genannten zweiwertigen Bindung beitragen, die zwei Atome miteinander verbindet.
Wie definieren wir also heute eine Wasserstoffbindung?
Eine Wasserstoffbrückenbindung ist in erster Linie eine elektrostatische Anziehungskraft. Sie entsteht zwischen einem Wasserstoffatom, das kovalent an ein elektronegativeres Donor-Atom oder eine Gruppe gebunden ist, und einem anderen elektronegativen Atom, das ein einsames Elektronenpaar trägt – dem Wasserstoffbrückenbindungsakzeptor.

In Wasser sind Wasserstoffbrückenbindungen eine heikle Wechselwirkung zwischen den Wasserstoff- und Sauerstoffatomen innerhalb eines Wassermoleküls und der Anziehung des Wasserstoffs zu einem benachbarten Sauerstoffatom. Willkommen bei der H-O-H … OH2-Wasserstoffbindung: eine nicht-kovalente molekulare Wechselwirkung, die sich ständig bildet und bricht.
Vor diesem Hintergrund sind die anomalen Eigenschaften von Wasser keine bloßen Zufälle. Sie stehen in engem Zusammenhang mit Wasserstoffbrückenbindungen und der Fähigkeit des Wassers, offene tetraedrische Wasserstoffbrückenbindungen zu bilden.
Das Tolle daran ist, dass Wasserstoffbrücken schwächer sind als kovalente Bindungen, aber stärker als die zufälligen thermischen Schwingungen im Wasser. Dieses feine Gleichgewicht verleiht dem Wasser seine einzigartigen Eigenschaften. Je nach Stärke der Wasserstoffbrückenbindungen kann sich das Wasser ausdehnen und ein Netzwerk bilden oder in die Lücken um andere Moleküle herum kollabieren.
Apropos Stärke: In flüssigem Wasser beträgt die Energie der Wasserstoffbrückenbindungen etwa 4-8kcal/mol – kein geringer Wert, vor allem wenn man ihn mit der durchschnittlichen Fluktuation bei thermischen Stößen bei 25°C vergleicht, die fünfmal schwächer ist. Die Stärke der Wasserstoffbrückenbindung eines Wassers wird durch den Bindungswinkel und die Temperatur beeinflusst. Eine geradlinige Bindung, die näher an 180° liegt, ist tendenziell stärker. Mit steigender Temperatur werden die Bindungen schwächer, was sich auf das Verhalten des Wassers auswirkt.
Ja, die Wasserstoffbrückenbindungen des Wassers sind ziemlich flüchtig, ihre Lebensdauer liegt zwischen 1 und 20 Pikosekunden. Gebrochene Bindungen bilden sich oft schnell wieder zurück, so dass das für die Struktur und Funktion des Wassers wichtige Netz von Wasserstoffbrückenbindungen erhalten bleibt.
Die subtilen und dynamischen Eigenschaften dieser Wasserstoffbindungsnetze erklären, warum sich Wasser bei verschiedenen Temperaturen unterschiedlich verhält. Im festen Zustand ist beispielsweise jedes Wassermolekül Teil von vier Wasserstoffbrückenbindungen, die in einem tetraedrischen Muster angeordnet sind. Diese Struktur ist entscheidend für die Bildung von Eis und seine anomal niedrigere Dichte im Vergleich zu flüssigem Wasser.
Es sind also die Wasserstoffbrückenbindungen, die die eigentümlichen und etwas ungewöhnlichen Eigenschaften des Wassers, die das Leben erhalten, weitgehend bestimmen.
Das Schöne daran ist, dass die Stärke der Wasserstoffbrückenbindungen für das Leben geradezu maßgeschneidert zu sein scheint. Was würde passieren, wenn die Stärke der Wasserstoffbrückenbindung nur ein winziges bisschen höher oder niedriger wäre?
Die Wasserstoffbrückenbindungen des Wassers: Das perfekte Gleichgewicht
Sprechen wir also über die Stärke der Wasserstoffbrückenbindungen von Wasser und warum sie so wichtig ist. Die Sache ist die: Schon eine kleine Veränderung ihrer Stärke kann die physikalischen Eigenschaften von Wasser verändern – wir sprechen hier von Schmelzpunkt, Siedepunkt, Dichte und Viskosität.
Ein kleiner Schubs kann die ganze Stimmung verändern.
Man hat erkannt, dass Wasserstoffbrückenbindungen Proteinmoleküle in ihrer nativen Konfiguration festhalten, und ich glaube, dass […] die Bedeutung der Wasserstoffbrückenbindungen für die Physiologie größer ist als die irgendeines anderen einzelnen Strukturmerkmals.
Linus Pauling | 1931
Wären diese Bindungen stärker, würde sich Wasser eher wie ein Glas verhalten – geordneter, strukturierter. Auf der anderen Seite würde eine Schwächung dieser Bindungen das Wasser näher an Stoffe wie Methan und Neon heranführen, bei denen es um schwache nichtkovalente Wechselwirkungen wie van der Waals geht.
Dieser Balanceakt der Stärke der Wasserstoffbrückenbindungen ist auch entscheidend dafür, wie Wasser mit anderen Stoffen interagiert. Stärkere Wasserstoffbrückenbindungen würden die Wasser-Wasser-Wechselwirkungen verstärken und damit die Bindungsfähigkeit des Wassers verringern, während schwächere Bindungen die Wasser-Oberflächen- oder Wasser-Lösungs-Wechselwirkungen reduzieren würden.
Im Hinblick auf die Löslichkeit würden starke Wasserstoffbrückenbindungen die Bildung von Hohlräumen begünstigen, die kleine hydrophobe Moleküle aufnehmen können, was deren Löslichkeit erhöht.
Was kann man also daraus lernen?
Die Stärke der Wasserstoffbrückenbindungen in Wasser ist ziemlich perfekt. Sie ist nicht so stark wie Superkleber, aber auch nicht so schwammig. Es ist wie ein perfekt ausbalancierter Reißverschluss, der die Dinge sanft zusammenhält und dabei genau das richtige Maß an Flexibilität zulässt.
Eine letzte persönliche Anmerkung
Wenn man wirklich darüber nachdenkt – wie alles im Wasser zusammenpasst, von seinem eigenartigen Verhalten bei 4°C bis hin zur Dynamik seiner Wasserstoffbrückenbindungen – ist es fast zu einfach, an einen übernatürlichen Konstrukteur zu glauben, der das alles inszeniert. Es ist die Art von kosmischem Märchen, die unsere Existenzsorgen lindert, ein tröstlicher Gedanke in den Weiten des Universums.
Aber bleiben wir einen Moment lang realistisch. Alles dem intelligenten Design zuzuschreiben, ist in etwa so, als hätten wir den kosmischen Jackpot gewonnen, nur weil das Universum in Geberlaune war. Das ist zwar eine schöne Geschichte, aber sie vereinfacht die Realität, ihre Zufälligkeit und das schiere Ausmaß der Wahrscheinlichkeiten zu sehr.
Die Wahrheit ist, dass die Dinge einfach passieren. Atome finden ihren Platz, Bindungen bilden sich, und Moleküle entstehen, alles nach den unerbittlichen Regeln der Quantenmechanik. Die Wasserstoffbrückenbindungen des Wassers bilden da keine Ausnahme.
Man muss sich das so vorstellen: Wir leben in einem Universum, das nur eines von unendlich vielen Universen ist, jedes mit seinen eigenen Ausgangsbedingungen. Es ist wie eine kosmische Lotterie, und unser Los hat zufällig die Gewinnzahlen für das Leben. Nicht, weil es vorherbestimmt war, sondern weil unser Universum die Würfel genau richtig geworfen hat.
Ist das eine befriedigende Antwort? Wahrscheinlich nicht. Die Idee eines Multiversums wirft mehr Fragen auf als sie beantwortet – leben wir in einer Simulation? – und lässt uns in einer ziemlichen Zwickmühle zurück. Aber egal, ob es sich um einen kosmischen Glücksfall handelt oder ob ein übernatürlicher Designer im Spiel ist, eines ist sicher: Wasser und seine Wasserstoffbrücken sind wirklich erstaunlich.
Nehmen wir uns also erst einmal einen Moment Zeit, um die Wunder eines so einfachen Moleküls zu bestaunen: H20.

